前言
自从1963年MERRIFIELD发展成功了固相多肽合成(SPPS)方法以来,经过不断的改进和完善,到今天这个方法已成为多肽和蛋白质合成中的一个常用技术,表现出了经典液相合成法无法比拟的优点。
固相合成的主要设计思想是:先将所要合成肽链的羟未端氨基酸的羟基以共价键的结构同一个不溶性的高分子树脂相连,然后以此结合在固相载体上氨基酸作为氨基组分经过脱去氨基保护基,并同过量的活化羟基组分反应接长肽链。重复(缩合-洗涤-去保护-中和和洗涤-下一轮缩合)操作,达到所要合成的肽链长度;最后将肽链从树脂上裂解下来,经过纯化等处理,即得所要的多肽。
将固相合成与其它技术分开来的唯一特征是固相载体。Merrifield和Erickon提出了一种有用的载体必须满足的普遍要求:
它必须包含反应位点,以使肽链能连在这些位点上,并在以后除去;它还必须对合成过程中的物理和化学条件稳定;载体必须允许在不断增长的肽链和试剂之间快速的、不受阻碍的接触;另外,载体必须允许提供足够的连接点以使每单位体积的载体给出有用产量的肽,并且必须尽量减少被(载体)束缚的肽链之间的相互作用。虽然这些要求的限度还不是很清楚。
并不是所有的要求都很容易达到;而且这里还有一些矛盾。在一个被液体介质自由渗透的轻度交联的胶状系统中,被缚肽链和溶解的试剂之间的不受阻碍的接触似乎可以很容易达到。传统的聚苯乙烯(PS)树脂就是这种类型;另一方面,被缚肽链之间的相互作用可以在一个固体表面功能化的、刚性更强的系统中达到。曾研究过表面功能化的硅,但它的容易可能很低。在这些极端之间有许多实用的或潜在的固相系统,对它们有各种描述:爆米花、巨孔、巨网和接枝共聚物。实际中发现简单的凝胶状树脂具有最好的综合性能。
用于多肽合成的高分子载体主要有三类:交联聚苯乙烯;聚酰胺;聚乙烯-乙二醇类树脂。
1、 聚苯乙烯-苯二乙烯交联树脂
1.1 树脂的选择和性质
聚苯乙烯-苯二乙烯交联树脂是多肽合成中最早、最常用的固相载体,其结构如图1.1。树脂是一种有机聚合物,作者认为在反应基团(接头)导入前的叫树脂比较适合,如聚乙烯-苯二乙烯。聚丙烯酰胺;树脂导入接头后则叫载体,但通常不用严格区分,可笼统使用。
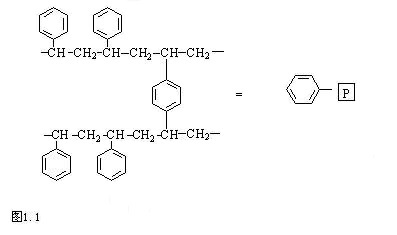
它由小珠体构成,直径20~150μm。为了使载体具有较大的网格空间足以容纳不断增长的较长肽链而且便于反应物进入载体内部,一般均采用1~2%交联度的PS树脂。但交联度过低,则溶胀性过大,不易过滤,而且机械性能不好,易于破碎。有人采用了另外一类办法。例如,①采用高达20%交联度的PS树脂。这种树脂的内部网格很小,类似于实心球。因此,肽链的接长反应只能在树脂表面上进行。②以玻璃珠或聚乙烯醇(PVA)为内核,聚合上一层低交联或无交联的PS。③用20%交联的PS珠体为核心,再在表面聚合上一层低交联的PS制成表层树脂或者在Kel-F上进行幅照接技。但①和②的应用较果并不理想。
1.2 反应基团的导入
上面的聚合物是起支撑和载带作用,并不能直接连上(第一个)氨基酸,必须要在苯环上导入反应基团(接头)。最简单而最常用的基团是氯甲基。它可以通过一个傅氏反应导入(式1.1):
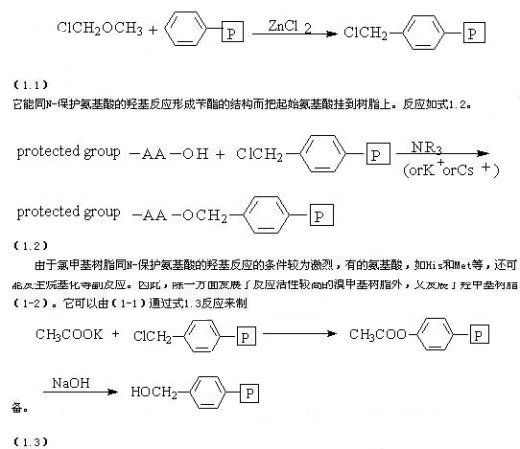
但是,由于用于氯甲基化的氯甲基乙醚有致癌作用;并且PS的氯甲基化被认为是一个潜在的麻烦反应。因此它增加附着在聚合物上其它官能团被污染的机会;同时,人们主要从两个方面对数值作了改进。①在苯环上导入-Cl、-NO2、-CONHR等吸电子基团;②将苄酯形式改为更易酸解的二苯甲酯或烷氧苄酯。在BOC化学中,通常认为①可能增强对酸的稳定性,不过裂解产率可能稍低一些,但总的还是认为有利的。Atheron和Sheppard则认为改进后的树脂可通过不包含氯甲基化和其它的傅氏反应来获得最大的优点。他们主要是讨论Fmoc方法的。如将对-羟甲基苯乙酸与氨甲基聚苯乙烯结合,得到所谓的PAM树脂(1-3)。在Boc和Fmoc化学中都有很广的应用。王(Wang)的对-烷氧基苯甲醇树脂(1-4)在Fmoc化学中也是很值得注意的。另外为了制备C-端为酰胺基的多肽,还可采用氨甲基树脂

这样得到的树脂替代值一般在0.3~1.2mmol/g之间;常规应用中0.5mmol/g较为理想。
Winger TM等报道,用N-(叔丁氧羰基)-2-氨基乙硫醚处理的氯甲基树脂(Merrilield树脂)的衍生物,可用固相合成方法来产生硫醇端多肽。此种多肽很适合随后的化学缀合反应等。Henning DS等则发现Arg或Lys侧基的Merrifield树脂能从溶液(PH=7.8)中吸着胆红素。但其它氨基酸侧基无此吸附现象。
1.3 其它应用和进展
1.3.1固相片段缩合
用Merrifield开创的逐个接长肽链的固相合成具有简单快速的优点。但这个方法存在一个问题,即由于各种内缺失肽和其它副产物的存在,使得合成的最后产物很难纯化,特别是在合成大肽或蛋白质的时候。此外,合成的肽越长,经过的缩合循环也越多,最后产物的产率也越低。而用固相片段缩合,不是每次接长一个氨基酸,而是接长一个肽段。这样可以在很大程度上解决上述问题:①减少了缩合循环的次数,可以提高最后产物的产率;②由于每一个反应的片段无论是用液相的或固相合成获得的都可以先经过纯化得到纯品,这样,最后的副产物也就相应地减少很多,而且所产生的各种内缺失肽的理化性质也和所需产物的性质有较大的差别,因而最后易于分离纯化。
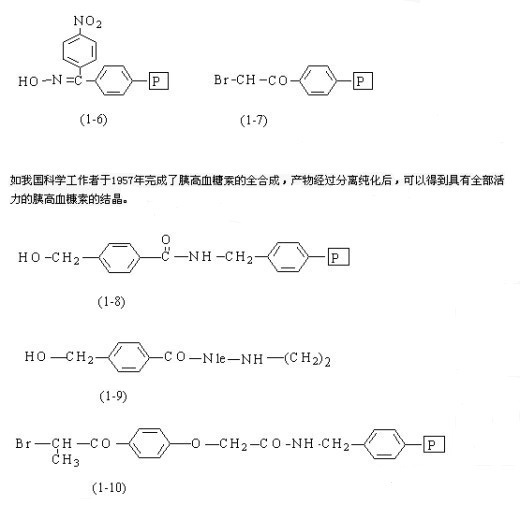
以后人们又发展了很多适用于固相片段缩合的树脂,如HMBA-AM树脂(1-6),Novasyn-KB树脂(1-7)。前者具有极好的物理和溶胀性能,并适合在间歇系统中应用;后者则应用于连续流动系统。另外还有肟树脂(1-8)、溴化Wang树脂(1-9)、溴化PPOA树脂(1-10)。其中(1-9)PS的交联度为1%,(1-10)则有2%。
1.3.2侧链挂树脂的方法
可能通过氨基酸的侧链功能团固定为树脂上。它的优点有二:①由于是侧链固定在树脂上,因此,既可以由CN伸长肽链,也可由NC伸长肽链;②由于侧链基团的多样化,因而树脂的固定基团也可以多样化,裂解时可选择一些更为温和的专一性的切落反应。当然,和将氨基酸的氨基固定在树脂上来伸长肽链一样,此方法也有很大的局限性,只在一些特殊情况下有应用。
2.聚酰胺
一般指聚丙酰胺凝胶。最先是由Sheppard等人提出用于多肽合成的 。将二甲基丙烯酰胺(2-1)、N、N`-双丙烯酰乙二胺(2-2)和不对称的二酰胺的衍生单体,如N-丙烯酰-N`叔丁氧羰基- β-丙烯酰-六次甲基二胺(2-3)共聚可得到珠状或无定形的丙烯酰胺载体(2-5a)。其中(2-2)为交联剂,(2-3)则是为了使载体带有可反应的氨基,及一个六碳隔离物链将官能团与聚合物主体分开。
采用聚丙烯酰胺作为多肽合成载体的原初设想是由于它具有与肽链相近的结构类型,不会像用PS树脂那样,随着合成肽链的增长而显著地改变载体的理化性质,因而可能更适用于大肽合成的情况。但最初的实践并不显示它比PS树脂具有更大的优越性。另外,还难以获得规则的球体,一些时候会得到大量的无定形聚合物,给操作带来困难。这可能和复杂的衍生物(2-3)有关。它与其它单体相比,具有非常不同的溶解性能和相分配性能,同时它也难以制备。
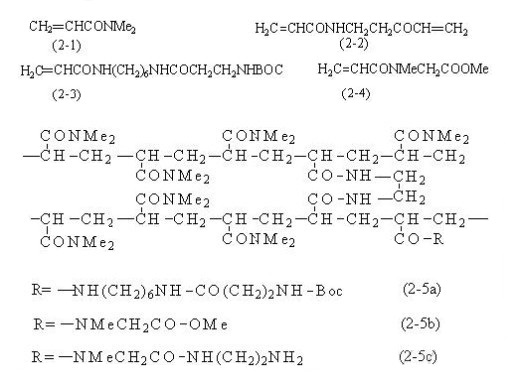
用丙烯酰-N-甲基甘氨酸甲脂(2-4)代替(2-3)解决了这些问题。这种功能化试剂和基本的单体(2-1)关系很接近,并且聚合可以不费力地得到漂亮的球体聚合物。另外,与(2-1)及(2-4)相似的结构似乎表明它们将以可比的速率聚合,这就提高了在整个树脂母体中官能团统一分配的相近程度。第二种树脂(2-5b)则有必要用一个后-聚合化学步骤将它转变成氨基聚合物(2-5c)。
聚酰胺树脂在极性溶剂如DMF中溶胀至于体积的10倍,在水中更高;而在非极性的DCM中则膨胀得低得多了。从这处意义上讲,它们的特性与树脂相反。
Sparrow JT等在制备聚酰胺树脂时用了一些功能单体:N-(2-(甲基磺酰基)乙酰羰基)-烯丙基胺(MSC-烯丙胺)、N-丙烯酰基-1,6-二氨基己烷HCl,或N-甲基丙烯酰基-1,3-二氨丙烷HCl 。树脂载荷0.15~1.4mmol/g。该树脂很适用于Fmoc化学合成。纯品肽可占粗品的80~95%,包括那些用传统PS树脂合成失败的氨基酸顺序。HaynieSL等准备了乙烯二氨修饰的聚酰胺树脂(Pepsn K),在上面合成出两亲性的多肽,并报道了这种多肽具有灭菌活性。
3.聚乙烯-乙二醇类树脂
3.1 聚乙烯-乙二醇-接技聚苯乙烯(PEG-PS)
它由不溶的PS母体构成,聚乙烯-乙二醇(PEG)链附着在上面。和以上讨论的聚酰胺树脂一样,它试图提高固相载体中肽链的溶剂化。研究过各种链长的PEG,但应用最成功是分子量在2000~3000Da之间的。
近年来用机器合成多肽发展很快。机器合成包括半自动(间歇式)和自动(连续流动)两种形式,它与手工合成相比,具有快速、完全、方便等优点。而由于PEG-PS树脂一般都有较好的物理化学特性,如溶胀性,物理稳定性,在流动系统中抗磨和抗机械压力能力等,因而,它也随之发展起来。如Kate SA,McGuinners BF 等最近报道该实验室研究的“低载荷”(替代值0.15~0.25mmol/g)和高载荷(0.3~0.5mmol/g)PEG-PS树脂的优点。
3.2 PEGA树脂及PEG类树脂的新应用
PEGA树脂是由Morten Melder发展起来的亲水性树脂,由PEG与酰胺基团交联而成。一般用于间歇式和连续流动多肽合成。它们的性质和PEG-PS树脂有很多相似之处,如NovaSyn TG树脂(3-1),其平均珠体大小为90μm,每克树脂有2.86×106个小珠体。由于它特别适合应用于连续流动多肽合成。NovaSyn TGA树脂(3-2),是在PS载体基础上连枝PEG,能抵抗很高的流速,使它成为快速合成长链肽的理想选择。其它如NovaSyn TGA树脂(3-3),被一个极好的Rink接头功能化。这样用TFA处理肽-树脂可以很容易地得到多肽酰胺。另外注意到此树脂有一个自由氨基,这将增加产物保存时的稳定性;同时意味着不需要经过一个预先去保护循环,就可以直接连上第一个氨基酸。它们的替代值一般为0.2~0.3mmol/g。Rink酰胺PEGA树脂也被一个Rink接头功能化,和前面介绍的(3-3)性质相似:不过它有更高的替代值(0.3~0.4mmol/g)。
近年来,PEG类型树脂(如PEGA)的一些新的应用越来越引起人们的兴趣。这些应用包括免疫学、树脂上酶合成及酶分析,和多肽文库的合成,而后者是发现新药物的强有力的工具。上述(3-1)就特别适合此类工作。
Auzanneau FI等研究了具有高含量PEG的三种类型的PEGA。树脂在从水到DCM的不同溶剂中膨胀很好,载荷为0.35mmol/g。他们在此树脂上合成出了几个高纯度的多肽,研究表明,作为相应的灭菌肽,它们有足够的致死活性。
Renil M,Ferreras M等合成出了两种类型的PEGA。由双/单-丙烯酰胺-PEG与丙烯酰胺PEG共聚,得出一个低交联度的树脂(类型I):进而,丙烯酰-肌氨酸乙酯与双-丙烯酰胺PEG共聚得到较多交联的树脂(类型II);载体在很广范围的溶剂中显示了高膨胀性,包括H2O、DCM、乙腈、TFA和甲苯。类型I通过单体组成的不同,给出的容量在0.07~1.0mmol/g之间,可应用于固相酶文库;用乙二胺处理类型II后,应用于连续流动多肽合成,且能给出相当好的产量和纯度。
Camarero.JA和Cotton GJ等报道,在一个3-巯基-3戊酮酰胺-PEG-聚-(N, N-二甲基丙烯酰胺)共聚物上载体(HS-PEGA)上,通过最优化的Boc-SPPS,可以从固相载体上直接得到未保护的多肽。这种方法降低了操作中的损失,明显提高了整个的化学偶联效率。他们合成了几个15~47个残基的肽,并且这种方法可以扩展到用来实现顺序的分子内络合,允许进入大得多的聚合肽和蛋白质系统。
4、固相多肽合成树脂和其它一些进展
除了以上三种普遍类型的固相载体,还有许多其它的载体被提出来并得到了有价值的应用。包括一些碳水化合物、接枝PEG聚酰胺、控制细孔度的硅玻璃和PE薄片等。而近年来的研究工作已从单纯的合成肽链,向功能化和自动化转变。
如上面提到的应用于免疫学和多肽文库的合成,这方面的工作有Teggy W和Frank R用于1,3-二氨基丙烷修饰Hi Trap琼脂糖凝胶,并接上一个酰胺接头得到的载体,McMurray JS用水相容性的聚丙烯酰胺类树脂,加上一个不裂解的接头,然后在固相载体上合成出目的多肽。将结果肽-树脂注射进动物以引出抗肽免疫反应。Buettner JA和Dadd CA等发展了一种新的亲水性树脂。这种树脂能用于多肽合成,以及直接估价为目标蛋白质而化合的多肽文库。他们用一个两色“多肽文库免疫印迹色谱分析”(PELICAN)技术来探测合成出的多肽文库顺序。Sebestyten F等亦提出了发展有色多肽和多肽文库的方法。Mery J等研究了二硫键作为Boc-Bzl SPPS 的多肽-树脂接头,认为这种方法具有生物化学上的应用潜力。直接将多肽偶联在活性蛋白载体上,可能应用于抗体的产生。
其它方面,Lloyd-Williams P等用了一个光不稳定的树脂,合成了一个完全被保护的八肽,此肽包含一个Met残基,他们指出在用光裂解时,此Met可以避免被氧化。
Englebrestn DR和Harding DR用氨丙基Perloza小珠纤维做载体,通过一个对TFA不稳的4-甲氧基苯氧乙酰基(HMPA)接头进行Fmoc SPPS。他们进行了连续流动和间歇式合成,并同一个PS载体和标准化的(ABI Fastmoc)SPPS方案合成出的一些肽进行了比较。他们关于Perloza工作的全面目标是为亲合色谱法和抗体产生了比较。他们关于Perloza工作的全面目标是为亲合色谱法和抗体产生出树脂束缚的多肽配位体。他们还于1993年将这种多肽树脂应用于从粗重组培养基中分离出的凝乳酶。
Zuckermann RN和Banville SC建立了一个机器人工作站,使去除对TFA不稳的侧链保护基团从酸不稳定树脂上裂解下多肽实现自动化。工作站建立在一个Zymark机器人手臂周围,并同一个多肽合成工作站连在一起。肽树脂样品用一个TFA/清除剂混合液来去保护和裂解。混合液适合所有通常的用Fmoc化学的保护基团。用水-醚连续抽提移走清除剂和反应副产物。设备每2hr裂解一个50~500mg的肽树脂样品,同时为肽提供一个10%Hac水溶液。用此设备得到的粗肽与残留的清除剂分开,产率在50~80%范围内。这种方法除了疏水的多肽外,对其他所有的多肽都适用;而且它最大程度地减少了人接触有毒的裂解试剂的机会。
5、展望
固相多肽合成已经有近40年的历史了;然而到现在,人们还只能合成一些较短的肽链,更谈不上随心所欲地合成蛋白质了,同时合成中的试剂毒性,昂贵费用,副产物等一直都是令人头痛的问题,而在生物体内,核糖体上合成肽链的速度和产率都是惊人的,那么,是否能从生物体合成蛋白质的原理上得到一些启发,应用在固相多肽合成(树脂)上,这是一个令人感兴趣的问题,也许是今后多肽合成的发展方向。
参考文献
[1] 多肽合成,黄惟德、陈常庆,科学出版社,1985
[2] Solid Phase Peptide Synthesis,Merrifield,Erickon
[3] Peptide Chemistry ,2nd edition ,Miklos Bodanszky,
[4] Chemical Approaches to the Synthesis of Peptide and Proteins, Paul Lloyd-Williams, Fernando Albericio, Ernest Giralt, 1997
[5] Winger TM, Ludovice PJ, Chaikof EL, convenient rout to thiol terminated peptides for conjugation and surface functionalization strategies, Bioconjug Chem 1995 May-Jun;6(3);
[6] Henning DS, Lajoie GA, Brown GR, St-Pierre LE,St-Pierre S, Polymer resins with amino acid containing pendants for sorption of biliubin. I. Comparison of Merrifield and polyamide resins, nt J Artif Organ 1984
[7] Synthesis notes, 1996
[8] Sparrow JT, Knieb-Cordonier NG, Objeyseskere NU, McMurray JS , Large-pore polydimethylacrylamide resin solid-phase peptide synthesis; applications in Fmoc chemistry, Pept Res 1996 Nov-Dec; 96(6);
[9] Kanda P, Kennedy RC, Sparrow JT, Synthesis of polyamide supports for use in peptide synthesis and as peptide-resin conjugates for antibody production, Int J Pept Protein Res 1991 Oct;38(4);
[10] Haynie SL, Crum GA Doele BA , Antimicrobial activities of amphiphilc peptide covalently bonded to a water-insoluble resin, Antimicrob Agents Chemother 1995 Feb; 39(2);
[11] Kates SA McGuinness BF, Blackburn C, etc, “high-load” polyethylene glycol-polystyrene( PEG-PS) graft supports for solid-phase synthesis, Biopolymers, 1998,4(3);
[12] Auzanneau FI, Meldal M, Bock K, synthesis, Characterization and biocompatibility of PEGA resins, J.Pept Sci 1995 Jan-Feb;1(1);
[13] Renil M, Ferreras M , Delaisee JM, Foged NT, Meldal M,PEGA supports for combinatorial peptide synthesis and solid-phase enzymatic library assays, J Pept Sci 1998 May ,4(3);
[14] Camarero JA, Cotton GJ,Adeva A, Muir TW, Chemical ligation of unprotected peptides directly from a solid support, J Pept Res 1998 Apr; 51(4);
[15] Tegge W , Frank R, Peptide synthesis on Sepharose beads, J Pept Res 1997 Apr;49(4);
[16] Mcmurray JS, The use of polyacrylamide-based peptide synthesis resins for the generation of antipeptide antibodies, Biopolymers 1998,47(5);
[17] Buettner JA, Dadd CA, Baumbach GA, Masecar BL, Hammond DJ, Chemically derived peptide libraries: a new resin and methodology for lead identification . Int J Pept Protein Res 1996 Jan-Feb;47(1-2);
[18] Sebestyen F, SzendreiG, Mak M,etc, Coloured Peptides: synthesis, properties and use in preparation pf peptide sub-library kits, J Pept Sci, 1998 Jun, 4(4);
[19] Mery J, Brugidou J, Derancourt J, Disulfide bond as peptide-resin linkage in Boc-Bzl SPPS.for potential biochemical applications, Pept Res 1992 Jul-Aug, 5(4);
[20] Lloyd-Williams P, Albericio F, Giralt E, convergent solid-phase peptide synthesis.VIII.Synthesis, using a photolabile resin , and purification of a methionine-containing protected peptide , Int J Pept Protein Res 1991 Jan;37(1);
[21] Englebretsen DR, Fmoc SPPS using Perloza beaded cellulose, Int J Pept Protein Res, 1994 Jun, 43(6);
[22] Englebretsen DR, Harding DR, Solid-phase synthesis of a peptide-ligand affinity matrix for isolation of chymosin, Pept Res, 1993 Nov-Dec, 6(6);
[23] Zuckermann RN, Banville SC, Automated peptide-resin deprotection/cleavage by a robotic workstation, Pept Res 1992 Mar-Jun;5(3);



