图1. 冠状病毒入侵机体的免疫过程及造成的机体损伤
一、什么是细胞因子风暴?
细胞因子风暴(cytokine storm)是指机体感染微生物后引起体液中多种细胞因子迅速大量的产生,如TNF-α、IL-1、IL-6、IL-12、IFN-α、IFN-β、IFN-γ、MCP-1和IL-8等,在学术上被称作“细胞因子风暴综合征CSS”。CSS是一种严重的危及生命的综合症状,标志着一种不受控制和功能失调的免疫反应,涉及淋巴细胞和巨噬细胞的持续激活和扩增,分泌大量的细胞因子,可能导致全身性炎症反应、多器官衰竭、高铁血红蛋白血症、急性呼吸窘迫综合征等疾病。

图2. 感染病毒后细胞因子风暴的发生过程
我们都知道,免疫系统是机体执行免疫应答及免疫功能的重要系统,具有识别和排除抗原性异物、与机体其他系统相互协调,共同维持机体内环境的稳定和生理平衡的作用。正常情况下,免疫系统是帮助机体清除感染,但是当免疫系统被激活到失去控制的时候,它就会伤害宿主,对机体进行猛烈的攻击。由于细胞因子是人体免疫系统抗击外源性感染的重要屏障之一,当病原侵入人体细胞后,细胞因子风暴就是一种求助信号,目的是让免疫系统全面出击,而引发的一场自杀式的行动,因此在消灭病原的过程中对自身也造成了非常大的伤害。首当其冲的是血管,细胞因子风暴使血管壁变得更容易穿透,令炎性物质浸润其他组织,扩大炎症范围,动静脉及毛细血管开始渗出血浆。同时因细胞因子风暴造成的一氧化氮大量释放,进一步破坏血管,同时,受损的内皮结构暴露,激活血液中的凝血因子,血小板异常聚集,使得正常的凝血功能遭到破坏,造成感染性休克。除此之外,过度的免疫反应中,免疫细胞会攻击人体自身细胞造成多器官衰竭,比如心脏,肾脏,肺脏等。
2005年Huang KJ 等人提出了SARS-CoV感染后可诱发大量IFN-γ相关的细胞因子风暴,该细胞因子风暴可能参与到SARS患者的免疫病理学损伤。2006年Jan-Inge Henter等人研究发现H5N1感染患者在临床上也会出现大量血细胞增多症、白细胞减少症和急性脑炎。2013年有研究团队提到H7N9急性期感染者的血清标本中,检测到细胞因子IP-10、MIG、MIP-1β、MCP-1、IL-6、IL-8和IFN-α升高。这些证据都表明,CSS是导致病毒感染后重症患者高死亡率的原因之一。
三、从细胞因子风暴角度挖掘新冠肺炎治疗新靶点
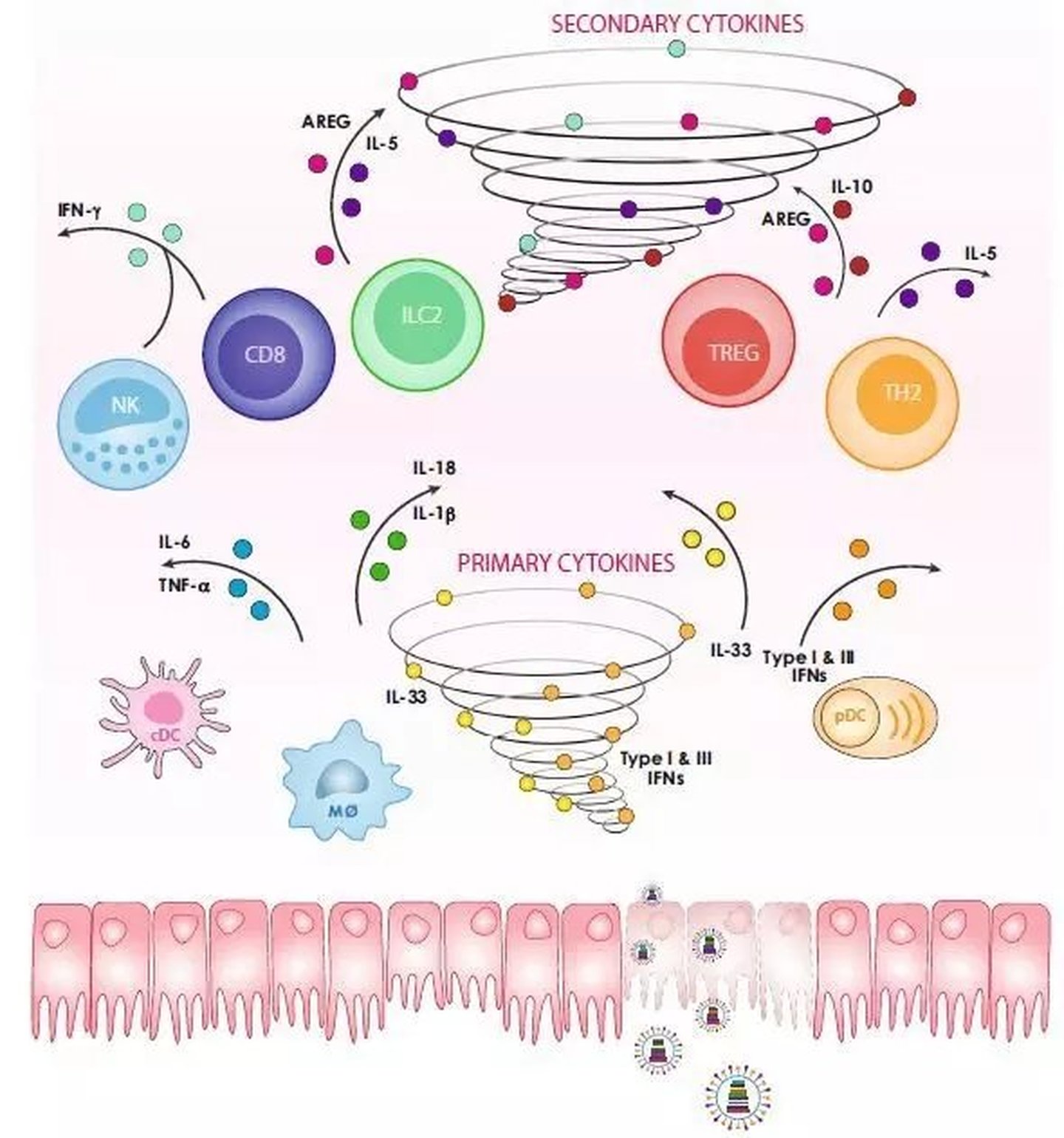
在本次疫情中,新冠病毒感染患者的肺部引发免疫反应,过量的免疫细胞和渗出液在肺部积累,拥塞气道加重患者缺氧,引发全身酸碱紊乱。当炎症失控波及全身,身体就如同浸泡在各种细胞因子,氧自由基,凝血因子,坏死组织等炎症介质的海洋里。细胞因子是免疫原、丝裂原或其他刺激剂诱导多种细胞产生的低分子量可溶性蛋白质,具有调节固有免疫和适应性免疫、血细胞生成、细胞生长、APSC多能细胞以及损伤组织修复等多种功能。细胞因子可被分为白细胞介素、干扰素、肿瘤坏死因子超家族、集落刺激因子、趋化因子、生长因子等。这里我们以干扰素为例,浅谈一下细胞因子在病毒感染的机体免疫系统中是怎样发挥作用的。
干扰素(IFN)是抵抗病毒感染的一道防线,浆细胞树突状细胞衍生的I型IFN对于控制病毒引起细胞病变至关重要,干扰素刺激基因(ISG)是诱导宿主内抗病毒状态的基因,它种类的多样性以及应用的广泛性,对病毒发病机理的研究提出了挑战。2014年,Vineet D. Menachery等人对致病性流感和SARS冠状病毒中ISG应答进行了分析,通过转录组学和蛋白质组学数据模型来对高致病性H5N1禽流感(HPAI)A病毒、2009年大流行的H1N1、SARS-CoV和MERS-CoV感染响应ISG进行比较,发现每种病毒对干扰素诱导的反应是不一样的。结合系统生物学和实验验证,鉴定了病毒控制免疫反应的策略,同时发现了通过IFN-I延迟产生的拮抗作用,并通过组蛋白的修饰来控制免疫应答的途径。延迟的IFN-I信号传导促进了致病性炎性单核巨噬细胞(IMM)的积累,导致肺细胞因子/趋化因子水平升高,血管渗漏和病毒特异性T细胞反应受损。IFN-α/β受体(IFNAR)或IMM损耗保护了小鼠免受致命感染,而不会影响病毒载量。这些结果表明,在感染致病性冠状病毒或其他呼吸道病毒的患者中,IFN-I和IMM可促进SARS-CoV致命感染,因此可将IFN-I和IMM作为潜在的治疗靶标。2011年,Yohichi Kumaki 等人证明了IFNα基因在SARS-CoV感染的小鼠模型中的保护作用和治疗用途。Lisa E. Hensley等人的研究发现重组人的IFN-β1α在体内能够有效抑制SARS冠状病毒的复制。
炎症因子是一把双刃剑,既可以保护机体,也会损伤集体,而炎症风暴后期,机体也相应会出现免疫反应亢进,同时又伴随着免疫功能低下。这是为细胞因子的抗炎和促炎作用,机体在正常情况下所引发的炎症反应是与感染程度相匹配的,但一旦机体循环遭到破坏变得紊乱,免疫功能就表现出一方面加重炎症反应,一方面减弱对病原的识别和吞噬功能。因此这些矛盾的存在,也为我们的治疗带来了困境。因此我们要最大限度降低药物副作用的同时保证抑炎效果的发挥。
以上研究从细胞因子的角度说明了病毒对宿主展开攻击的各种方式,我们知道肺部病变是最重要的感染特征,但机体是一个统一而协调的整体,保护我们的免疫系统也是牵一发而动全身,我们除了知道病毒会感染肺部器官,也应该从不同的视角去审视病毒的作战策略。
SARS-CoV-2的突然侵袭,让我们猝不及防,随着科技水平飞升和防控管理的改善,我们对病毒的了解也逐渐增多,在与病毒作战的过程中,研究者们的成果是我们战胜病毒的一个个有力武器,目前国内疫情已得到有效控制,但国际特别是欧美国家疫情形势依然愈演愈烈。
参考文献:
1. Martin Spiegel, Andreas PichlMair, Elke Muhlberger et al. The antiviral effect of interferon-beta against SARS-Coronavirus is not mediated by MxA protein. Journal of Clinical Virology. 2004.
2. Lisa E. Hensley, Elizabeth A. Fritz, Peter B. Jahrling et al. Interferon-β 1 a and SARS Coronavirus Replication. Emerging infectious diseases. 2004.
3. Rudragouda Channappanavar, Anthony R Fehr, Rahul Vijay et al. Dysregulated type I interferon and inflammatory mobovyte-macrophage responses cause lethal pneumonia in SARS-CoV-infected mice. Cell Host Microbe. 2016.
4. Luisa Cervantes-Barragan, Ulrich Kalinke, Roland Zust et al. Type I IFN-Mediated protection of Macrophages and Dendritic Cells Secures Control of Murine Coronavirus Infection. The journal of Immunology. 2009.
5. Luisa Cercantes-Barragan, Roland Zust, Friedemann Weber et al. Control of coronavirus infection through plasmacytoid dendritic-cell-derived type I interferon. Immunobiology. 2007.
6. Yohichi Kumaki, Jane Ennis, Ramtin Rahbar et al. Single-dose intranasal administration with mDEF201(adenovirus vectored mouse interferon-alpha) confers protectioni from mortality in a lethal SARS-CoV BAL B/c mouse model. Antiviral research, 2011.
7. Vineet D. Menachery, Amie J. Eisfeld, Alexandra Schafer et al. Pathogenic Influenza Viruses and coronaviruses utilize similar and contrasting approaches to control interferon-stimulated gene responses. mBio. 2014.
8. Kao-Jean Huang, Ih-Jen Su, Michel Theron et al. An interferon-γ-related cytokine storm in SARS patients. Journal of medical virology. 2005.
9. Weiren Luo, Hong Yu, Jizhou Gou et al. Clinical pathology of critical patient with novel coronavirus pneumonia (COVID-19). Priprints. 2020.
10. Jan Inge Henter, Chun Bong Chow, Chi Wai Leung, Yu Lung Lau. Cytotoxic therapy for severe avian influenza A (H5N1) infection. Hypothesis. 2006.
11. Jiangfang Zhou, Dayan Wang, Rongbao Gao et al. Biological features of novel avian influenza A (H7N9) virus. Nature research. 2013.



